目前免疫檢查點阻滯劑在腫瘤免疫治療中受到關注,靶向程序性細胞死亡蛋白1(programmed cell death,PDCD1)和細胞毒T淋巴細胞相關蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA4)治療劑的成功為癌癥治療提供了更多的選擇。然而,盡管此療法在一些患者中能夠消除腫瘤并實現患者的長期生存,但并非對所有患者都有效果,許多患者對基于免疫檢查點阻斷的單一藥物治療有抗藥性。因此,具有不同作用機制或不同靶點的新型免疫調節藥物亟待開發。
腫瘤壞死因子受體超家族成員4(tumor necrosis factor receptor superfamily member 4,TNFRSF4)(也稱為OX40或CD134)是TNF受體超家族的一員,在活化的T細胞上高度表達,有一個已知配體TNFSF4(也稱為OX40L或CD252),主要在活化的抗原呈遞細胞上表達。TNFRSF4與配體結合并激活后,T細胞中的下游細胞內信號通路激活,導致核因子κB(nuclear factor-kappa B,NF-κB)的轉錄激活。
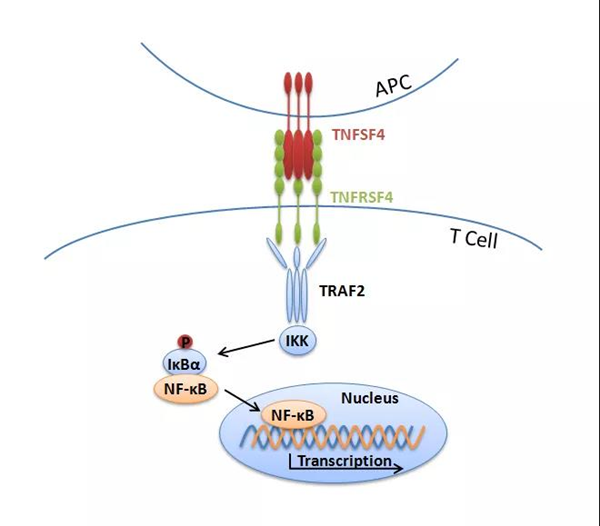
目前,在早期癌癥臨床試驗中測試了幾種anti-TNFRSF4激動性單克隆抗體,并且有越來越多的臨床前實驗支持anti-TNFRSF4激動性單克隆抗體的臨床研發。人類和小鼠的TNFRSF4只具有69.17%的同源性,為進一步研究TNFRSF4相關藥物,使用TNFRSF4人源化小鼠是更好的選擇。
采用CRISPR/Cas9的方法將人源TNFRSF4基因導入到小鼠的受精卵中,同時敲除小鼠內源TNFRSF4基因的表達。TNFRSF4人源化小鼠(TNFRSF4h/h)及TNFRSF4敲除小鼠(TNFRSF4-/-)表型正常。通過建立基因結構和調節方式與人類相似的模型,改善TNFRSF4在人與小鼠中種屬差異導致的在臨床測試與動物實驗結果差異,從而使藥物評價的結果更加客觀。文章發表在《中國實驗動物學報》上。

按照實驗方案(圖1)。將轉錄后的sgRNA和Cas9 mRNA混合后通過顯微注射技術注射到將C57小鼠受精卵中,移植到ICR假孕鼠子宮內,生出2批小鼠,使用PCR進行基因型鑒定。根據PCR結果,選取分子量不同于野生型條帶的PCR產物測序并與野生型小鼠TNFRSF4基因序列比較。結果顯示,第1批小鼠中,2#,7#小鼠發生基因敲入,第2批小鼠中,7#小鼠發生基因敲除。將F0代小鼠與C57小鼠進行雜交,獲得雜合子TNFRSF4h/m或TNFRSF4+/-,將雜合子互交并將子代進行基因型鑒定(圖2),得到純合敲入或敲除小鼠TNFRSF4h/h或TNFRSF4-/-。
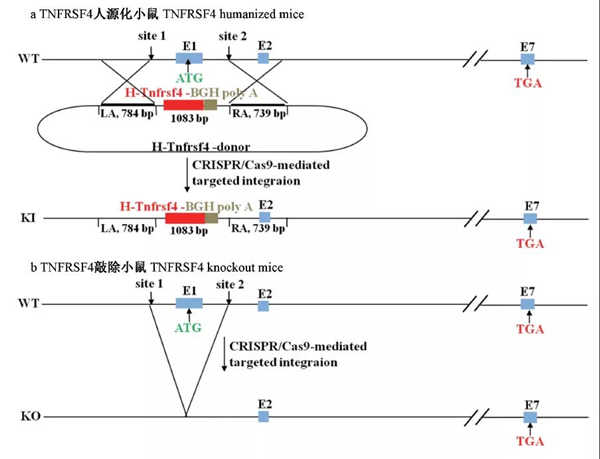
圖1 TNFRSF4人源化及敲除小鼠建立方案
注:在sgRNA和Cas9mRNA的參與下,小鼠TNFRSF4第一外顯子被剪切。a:使用人TNFRSF4的CDS區及BGH Poly A組成的1083 bp閱讀框,成功替換了小鼠TNFRSF4第一外顯子的編碼區,建立TNFRSF4人源化小鼠。b:閱讀框未能替換小鼠TNFRSF4第一外顯子的編碼區,建立TNFRSF4敲除小鼠。
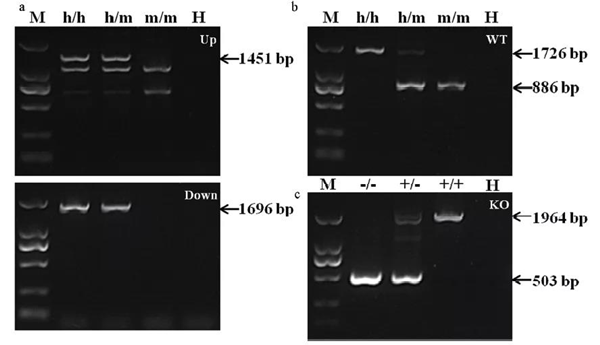
圖2 PCR鑒定子代小鼠基因型
注:使用PCR鑒定子代小鼠基因型,突變可傳代。M:Marker(TaKaRa,DL2000);H: 水。h/h:TNFRSF4人源化純合子小鼠;h/m:TNFRSF4人源化雜合子小鼠;m/m:同窩野生型小鼠。a:鑒定使用引物M-TNFRSF4-UP,M-TNFRSF4-DOWN。b:鑒定使用引物M-TNFRSF4-WT。c:-/-:TNFRSF4基因敲除純合子小鼠;+/-:TNFRSF4基因敲除雜合子小鼠;+/+:野生型小鼠。使用鑒定引物M-TNFRSF4-KO。
為了鑒定小鼠是否在蛋白水平發生TNFRSF4敲除或人源化轉入,對TNFRSF4-/-和TNFRSF4-+/+小鼠外周血進行流式細胞鑒定,并使用RT-PCR鑒定TNFRSF4h/h和TNFRSF4m/m小鼠各組織中mRNA表達(圖3)。結果顯示,在TNFRSF4-/-小鼠的外周血中,TNFRSF4表達被敲除,在TNFRSF4h/h小鼠中,鼠源TNFRSF4被人源替代。
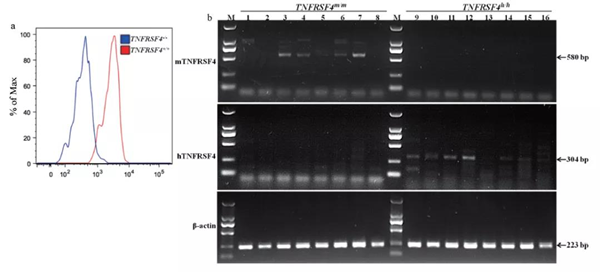
圖3 TNFRSF4-/-及TNFRSF4h/h小鼠中TNFRSF4表達
注:a:流式細胞術統計TNFRSF4+/+和TNFRSF4-/-小鼠培養的脾細胞中CD3+CD4+T細胞中TNFRSF4+細胞的直方圖。b:TNFRSF4在TNFRSF4m/m(1-8)和TNFRSF4h/h小鼠(9 ~ 16)心(1,9)、肝(2,10)、脾(3,11)、肺(4,12)、腎(5,13)、胸腺(6,14)、腦(7,15)、骨髓(8,16)中的表達。mTNFRSF4:人特異性TNFRSF4引物;mTNFRSF4:小鼠特異性TNFRSF4引物。β-actin:小鼠特異性β-actin引物。M:Marker(TaKaRa,DL2000)。
HE染色結果顯示,在TNFRSF4-/-小鼠及TNFRSF4h/h小鼠的各組織中,沒有觀察到淋巴細胞的浸潤(圖4),且全身病理檢查未發現異常。根據我們的觀察結果表明,TNFRSF4h/h 及TNFRSF4-/-小鼠發育正常,在6個月內沒有觀察到自身免疫性疾病發展的跡象。利用流式細胞術檢測了TNFRSF4h/h小鼠外周血中各類細胞的比例,發現其外周血中B細胞(B220+)、T細胞(CD3+、CD4+、CD8+)、粒細胞(CD11b+)和NK(NK1.1+)細胞的比例都沒有明顯差異(圖5)。結果說明人源化TNFRSF4基因后沒有改變正常生理狀態下小鼠免疫系統的組成。因此,在TNFRSF4h/h小鼠中,人源TNFRSF4等位基因可以替代小鼠TNFRSF4基因。

圖4 組織HE染色
注:m/m:野生型小鼠;h/h:TNFRSF4人源化純合子小鼠;+/+:野生型小鼠;-/-:TNFRSF4基因敲除純合子小鼠。
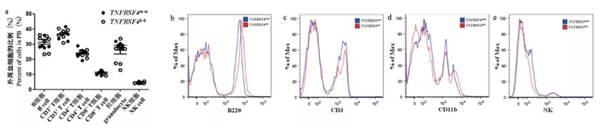
圖5 在TNFRSF4h/h小鼠外周血中不同免疫細胞的比例
注:a:流式細胞術統計不同免疫細胞在外周血中的比例。b ~ e:流式細胞術檢測外周血中B220(b),CD3(c),CD11b(d),NK1.1(e)表達。
綜上所述,利用CRISPR/Cas9技術,建立TNFRSF4基因人源化和敲除小鼠模型,在TNFRSF4人源化小鼠中穩定表達人源TNFRSF4,未檢測到小鼠TNFRSF4表達。在TNFRSF4敲除小鼠中未檢測到TNFRSF4表達。TNFRSF4人源化及敲除小鼠出生后6個月內均正常存活,組織病理學表型及免疫系統未見明顯異常。該模型可用于篩選及評估與TNFRSF4基因相關的治療性抗體及藥物或研究TNFRSF4在免疫過程中作用機制。
目前,TNFRSF4敲除和人源化小鼠模型模型信息已提交到國家動物模型資源共享信息平臺(簡稱信息平臺)。信息平臺致力于實驗動物資源與疾病動物模型信息的收集和共享,希望通過我們的努力,通過信息的集成與共享,更好的服務于國家重大科技攻關,助力于生物醫藥產業的發展。
歡迎廣大科研工作者通過信息平臺進行咨詢及訂購。我們歡迎致力于實驗動物領域研究的各位專家在我們的平臺分享您的研究成果,也歡迎各位專家在我們平臺開展動物模型相關技術的討論和研究!
參考文獻:
黃藝瀅, 白琳,雷雪裴, 李珂雅, 李欣悅, 侯麗雅, 石桂英. 腫瘤壞死因子受體超家族成員 4(TNFRSF4)敲除和人源化小鼠模型的建立[J]. 中國實驗動物學報, 2021, 29(2):137~144.





 17312606166
17312606166