進化論告訴我們,物競天擇,適者生存。不知道大家有沒有思考過一個問題,同性性行為不能產生后代,那為什么在自然選擇中同性性行為的基因依然能夠留存下來呢?以往的研究表明:雙性性行為者的基因可能具有生殖優勢,而他們的孩子會攜帶同性遺傳基因,這解釋了其遺傳持續性。
盡管同性基因可以得以遺傳,但不論怎么說,同性之間即使是真愛,想要繁衍后代,還是需要通過異性。但是,傳統認知也是可以被現代科學顛覆的!這不,在Nature的一篇報道中,自然生殖中的性別限制被解開,科學家在體外將雄性小鼠的誘導多能干細胞(iPSCs)轉化為功能性卵細胞,進而通過這些卵細胞產生雙父系后代。該研究由Kenta Murakami等人發表,題為Generation of functional oocytes from male mice in vitro。

本顛覆性實驗的起點是雄性小鼠的多能干細胞(PS細胞),這些細胞具有變成體內任何類型細胞的潛力。然而,由于它們攜帶的是XY性染色體,按照自然界的規律,這些細胞無法發育成卵母細胞。但是,科學家們通過一系列精細的操作,改變了這些細胞的染色體組成,將它們從XY轉變為XX,從而模擬了雌性細胞的特征。
那他們究竟做了些什么?
首先,科學家們使用了CRISPR-Cas9基因編輯技術,這是一種實現在基因組中精確剪切和插入的工具。通過CRISPR-Cas9系統在小鼠胚胎干細胞(ES cells)中敲入DsRed(一種紅色熒光蛋白)至X染色體,以監測X染色體的數量。
由于干細胞長期培養過程中會發生染色體改變,大約6% 的胚胎干細胞會自發失去Y染色體。因此,自然培養后通過篩選,研究人員成功獲取了丟失Y染色體的ES細胞,生成了XO型的ES細胞。
隨后,研究人員使用逆轉紡錘體組裝檢查點抑制劑處理XO型ES細胞,對它們繼續培養獲得X染色體復制的ES細胞。為了驗證生成的XX ES細胞的基因完整性,研究人員通過熒光激活細胞排序和熒光原位雜交等方法,確認了X染色體的復制,從而產生了XX型的ES細胞。
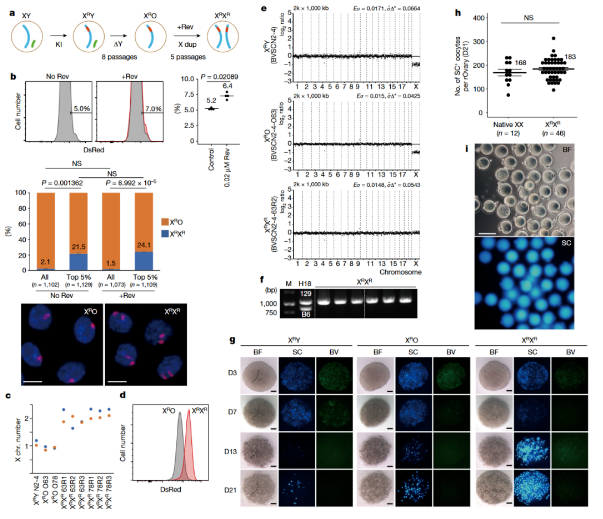
圖1:ES細胞中的性別轉換和卵母細胞體外生產
接下來,性轉換后的XX型ES細胞被誘導分化為原始生殖細胞樣細胞(PGCL cells),隨后與雌性胚胎日12.5天的生殖腺體細胞聚集,并在體外分化(IVDi)培養條件下培養。
在這個系統中,細胞開始分化,逐漸轉變為能夠產生卵母細胞的前體細胞。這個過程就像是在細胞的一生中按下了“重置”按鈕,讓它們重新獲得了發育成卵母細胞的能力。
實驗結果發現,重建后的XX型胚胎干細胞產生的卵母細胞的數目明顯大于來自親代XY和XO型胚胎干細胞產生的卵母,并且這些體外培養的卵母細胞在很多方面都與自然狀態下的卵母細胞相似。
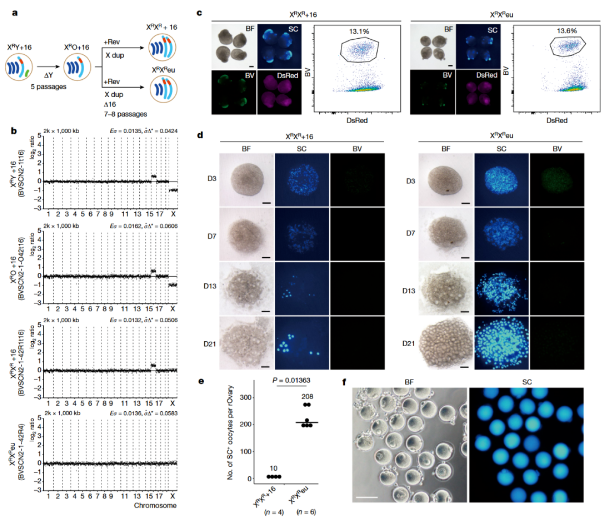
圖2:常染色體非整倍體XY ES細胞的卵母細胞生產
隨后,研究人員還研究了三體16號染色體(一種唐氏綜合癥模型)對卵子形成的影響。
通過使用reversine處理,他們對卵母細胞進行了誘導,發現16三體沒有破壞PGCLC分化,但大部分PGCLC無法分化為原始卵母細胞。與此形成鮮明對比的是,來自整倍體ES細胞的原始卵母細胞能夠分化成為 PGCL細胞和初級卵母細胞。這說明:在IVDi時期,常染色體非整倍體在早期階段嚴重損害卵子生成,但在糾正非整倍體后,體外卵子生成能力得到恢復!
為了評價性轉換生成的卵母細胞功能,一個金標準是看它們是否產生后代,并且,若來自雄性體細胞的誘導多功能干細胞(iPS)能夠誘導生成這種有功能的卵母細胞,其應用范圍將會更加廣泛。
因此,研究者取8周齡雄性小鼠的尾端成纖維細胞獲得iPS細胞用于性別轉換。他們發現XX iPS細胞成功分化為PGCL細胞、原代卵母細胞、GV卵母細胞和MII卵母細胞。并且,這些MII卵子能夠與野生型精子進行體外受精(IVF),并發育成兩細胞胚胎。接著,研究人員將這些兩細胞胚胎移植到假孕的ICR小鼠中,結果有1.1%的胚胎能夠發育成活體幼崽。這些幼崽的生長和體重與之前報道的使用XX型iPS細胞來源的卵子產生的后代相似,且所有測試中,幼崽均顯示出正常的生育能力。
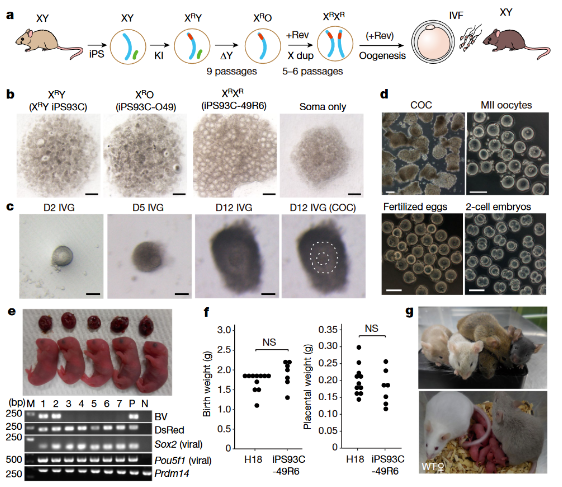
圖3:性轉化的iPS細胞體外分化的卵母細胞產生的后代
由于性別轉換系統高度依賴于整合在X染色體上的報告基因,因此作者試圖找到一種內源性標記物以區分iPS生產的XX胚胎干細胞和與iPS生產的XO胚胎干細胞。
通過比較兩種基因型ES細胞的轉錄組,研究人員發現CD38的表達水平在XX型ES細胞中比XO型ES細胞高2.9倍。利用抗CD38抗體和FACS,研究人員能夠從XO型ES細胞中分離出XX型ES細胞,這些細胞隨后能夠分化為PGCL細胞,并在IVDi培養中產生卵子。
總的來說,這項研究展示了在體外條件下將雄性小鼠的干細胞轉化為具有功能的雌性卵子的可能性,并證明了這些卵子能夠產生具有生育能力的后代。這一發現對未來的生殖生物學研究和生殖醫學具有重要的意義。





 17312606166
17312606166