基因編輯小鼠是指通過基因編輯技術(shù)對特定目標(biāo)基因進行“修飾”,從而在小鼠體內(nèi)實現(xiàn)DNA片段的刪除或添加。基因編輯小鼠被廣泛用于研究基因?qū)π∈蠊δ艿挠绊懀脖挥糜跇?gòu)建各種疾病模型,模擬人類疾病的發(fā)生發(fā)展過程以及相應(yīng)藥物的研發(fā)。
基因編輯小鼠的制備方式主要有兩種,一種是ES細胞囊胚注射,另一種是受精卵顯微注射。無論哪種方式,基因編輯都是在受精卵水平進行操作,為了拿到基因編輯動物,則必須經(jīng)過胚胎移植,在動物體內(nèi)發(fā)育為完整的個體。
● 基于采用ES細胞囊胚注射方式獲得基因修飾小鼠的過程如下:
先對小鼠胚胎干細胞進行基因編輯,將基因打靶獲得的陽性ES細胞進行囊胚注射,再胚胎移植到假孕母鼠體內(nèi)獲得高嵌合小鼠,高嵌合小鼠進一步與野生型小鼠進行交配,即可最終獲得基因編輯小鼠。
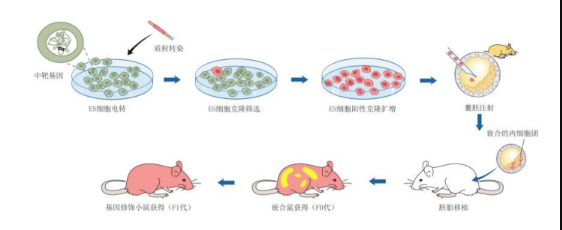
Fig.1 采用ES細胞囊胚注射方式獲得基因修飾小鼠的過程
● 基于受精卵顯微注射技術(shù)構(gòu)建基因修飾小鼠的過程如下圖所示,
主要包括:gRNA設(shè)計和篩選,sgRNA表達載體構(gòu)建,顯微注射,胚胎移植,小鼠繁殖等過程。
Fig.2 采用受精卵顯微注射方式獲得基因修飾小鼠的過程
胚胎移植除了可以用在基因編輯小鼠構(gòu)建中,還有很多重要的應(yīng)用:
凈化和快繁
為了保證小鼠的健康和疾病預(yù)防,一般外來小鼠必須經(jīng)過隔離和凈化才能進入SPF級動物房。當(dāng)前,凈化的主要技術(shù)是:體外受精(In Vitro Fertilization, IVF)+胚胎移植(Embryo Transfer, ET)技術(shù)(IVF-ET),其基本原理:小鼠自身雖然被感染,但小鼠的精子或卵細胞在體內(nèi)是干凈無菌的。因此將雄鼠處死后取出精子,將精子激活后與超排的卵母細胞進行體外受精拿到受精卵,再移植到SPF級代孕小鼠的子宮中,這樣可以得到SPF級的小鼠后代。
IVF技術(shù)還具有一個重要應(yīng)用--快速擴繁。使用IVF技術(shù)可短時間獲得大量子代小鼠,并且減少組內(nèi)小鼠周齡差異,提高實驗數(shù)據(jù)一致性。應(yīng)用于基因修飾小鼠則能夠一次性獲得大量相同基因型小鼠。
在小鼠進入動物房前,選擇IVF凈化服務(wù),在凈化的同時,還能達到快速繁育的目的,同時獲得更多數(shù)目的子代鼠,效率高,縮短繁育周期,極大地加快科研進度。
挽救雄鼠不育的品系
單精子顯微注射技術(shù)(Intracytoplasmic sperm injection,ICSI),是指通過顯微操作系統(tǒng)將單個精子頭注入小鼠卵子胞漿內(nèi),再移植到代孕小鼠體內(nèi)發(fā)育成小鼠的技術(shù)。該技術(shù)用于挽救因為精子無活力或者活力低造成雄性不育的小鼠品系。
胚胎(精子)復(fù)蘇
胚胎(精子)復(fù)蘇基于胚胎(精子)凍存技術(shù),胚胎(精子)凍存常用于珍貴品系的保種,通過一定的降溫程序及保護措施將胚胎(精子)進行凍存,這種方法可以降低品系維持成本,且維持過程中不受疾病、不育等因素的影響。胚胎(精子)復(fù)蘇是指通過升溫的辦法將凍存的胚胎(精子)解凍,存活的胚胎體外培養(yǎng)一段時間后移植到代孕小鼠子宮內(nèi)發(fā)育,進而獲得凍存品系小鼠活體的技術(shù)。其中胚胎凍存相比于精子凍存具有復(fù)蘇后存活率高、移植后懷孕率高的特點,具有明顯優(yōu)勢,但其冷凍技術(shù)難度高,受限于專業(yè)機器--程序冷凍儀,建議交給專業(yè)機構(gòu)來進行。
綜上所述,小鼠的胚胎移植技術(shù)是制備基因修飾動物、凈化、保種過程中的必需的、關(guān)鍵的技術(shù)手段,對于實驗動物學(xué)研究及生命科學(xué)研究具有重要價值。





 17312606166
17312606166